[化学——选修3: 物质结构与性质]
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格近中等优点。
①Cu的基态原子价电子排布式为_____________,
②Ni的基态原子共___________有种不同能级的电子。
(2)制备CrO
2Cl
2的反应为K
2Cr
2O
7+3CCl
4=2KCl+2CrO
2Cl
2+3COCl
2↑
①上述化学方程式中非金属元素电负性由大到小的顺序是,________________,(用元素符号表示)
②COCl
2分子中各原子均满足8电子稳定结构,COCl
2分子中σ键和π键的个数比为_______________;中心原子的杂化方式为_____________。
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni
2+和Fe
2+的离子半径分别为6.9×10
-2nm和7.8×10
-2nm。则熔点NiO__________FeO (填“>”、“<”或“=”),原因是_____________。
(4) Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如右图所示:
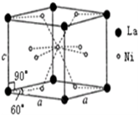
①该晶体的化学式为_____________;
②已知该晶体的摩尔质量为Mg /mol,密度为dg/cm
3,设N
A为阿伏加德罗常数的值。则该晶胞的体积
是_____________ cm
3 (用M、d、N
A的代数式表示)
③该晶体的内部具有空隙,且每个晶胞的空腺中储存6 个氢原子比较稳定。已知: 标准状况下氢气的密度为ρg/cm
3。
储氢能力=

若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______________。(用M、d、ρ的代数式表示)


 2NO2(g) △H1=+67.8 kJ/mol
2NO2(g) △H1=+67.8 kJ/mol O2(g)+2NO(g) △H2=+116.2 kJ/mol
O2(g)+2NO(g) △H2=+116.2 kJ/mol 2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________ 2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________ N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:


 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。

 2SO3(g) 的平衡常数为____________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。
2SO3(g) 的平衡常数为____________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。 2SO3(g) △H<0的化学平衡常数(K):
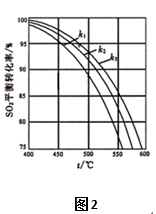
2SO3(g) △H<0的化学平衡常数(K): 2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图2所示:图中k1、k2、k3的大小顺序为____________。
2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图2所示:图中k1、k2、k3的大小顺序为____________。